2. Sifat senyawa ion
Sifat Fisis Senyawa Ion
Beberapa sifat senyawa ion, antara lain:
- Memiliki Titik Didih dan Titik Leleh yang Tinggi
- Keras Tetapi Rapuh
- Berupa Padatan pada Suhu Ruang
- Larut Dalam Pelarut Air, Tetapi Umumnya Tidak Larut Dalam Pelarut Organik
- Tidak Menghantarkan Listrik Dalam Fasa Padat, Tetapi Menghantarkan Listrik Pada Fasa Cair
3. Penentuan jenis atom yang umunya berikatan kovalen
4. dan 5. Nama senyawa ion
• Na+ + Cl– -> NaCl natrium klorida
• 2 Na+ + SO42– -> Na2SO4 natrium sulfat
• Fe2+ + 2Cl– -> FeCl2 besi(II) klorida
• Al3+ + PO43– -> AlPO4 aluminium fosfat
• Mg2+ + CO32– -> MgCO3 magnesium karbonat
• 3 K+ + AsO43– -> K3AsO4 kalium arsenat
Daftar Beberapa Jenis Kation
1. Na+ Natrium
2. K+ Kalium
3. Ag+ Argentum/Perak
4. Mg2+ Magnesium
5. Ca2+ Kalsium
6. Sr2+ Stronsium
7. Ba2+ Barium
8. Zn2+ Seng
9. Ni2+ Nikel
10. Al3+ Aluminium
11. Sn2+ Timah(II)
12. Sn4+ Timah(IV)
13. Pb2+ Timbal(II)
14. Pb4+ Timbal(IV)
15. Fe2+ Besi(II)
16. Fe3+ Besi(III)
17. Hg+ Raksa(I)
18. Hg2+ Raksa(II)
19. Cu+ Tembaga(I)
20. Cu2+ Tembaga(II)
21. Au+ Emas(I)
22. Au3+ Emas(III)
23. Pt4+ Platina(IV)
24. NH4+ Amonium
Sumber: Chemistry, The Molecular Nature of Matter & Change, Martin S. Silbergberg, 2000.
Daftar Beberapa Jenis Anion
1. OH– Hidroksida
2. F– Fluorida
3. Cl– Klorida
4. Br– Bromida
5. I– Iodida
6. CN– Sianida
7. O2– Oksida
8. S2– Sulfida
9. NO2– Nitrit
10. NO3– Nitrat
11. CH3COO– Asetat
12. CO32– Karbonat
13. SiO32– Silikat
14. SO32– Sulfit
15. SO42– Sulfat
16. C2O42– Oksalat
17. PO33– Fosfit
18. PO43– Fosfat
19. AsO33– Arsenit
20. AsO43– Arsenat
21. SbO33– Antimonit
22. SbO43– Antimonat
23. ClO– Hipoklorit
24. ClO2– Klorit
25. ClO3– Klorat
26. ClO4– Perklorat
27. MnO4– Permanganat
28. MnO42– Manganat
29. CrO42– Kromat
30. Cr2O72– Dikromat
Nama senyawa ion adalah rangkaian nama kation (di depan) dan nama anion (di belakang), angka indeks tidak disebut.
Contoh:
• NaCl = natrium klorida
• CaCl2 = kalsium klorida
• Na2SO4 = natrium sulfat
• Al(NO3)3 = aluminium nitrat
Jika unsur logam mempunyai lebih dari satu jenis bilangan oksidasi, maka senyawa-senyawanya dibedakan dengan menuliskan bilangan oksidasinya, yang ditulis dalam tanda kurung dengan angka Romawi di belakang nama unsur logam tersebut. Contoh:
• Cu2O = tembaga(I) oksida
• CuO = tembaga(II) oksida
• FeCl2 = besi(II) klorida
• FeCl3 = besi(III) klorida
• Fe2S3 = besi(III) sulfida
• SnO = timah(II) oksida
• SnO2 = timah(IV) oksida
6. Nama senyawa kovalen
1.
Penamaan senyawa mengikuti urutan berikut:
Bi – Si – As – C – P – N – H – S – I – Cl – O –F
kemudian di beri akhiran -da
2.
Jika senyawa non logam mempunyai lebih dari
satu macam bilangan oksidasi , maka ada 2 cara penamaan
a) Memakai valensi (bilangan
oksidasi) angka Romawi (SISTEM STOCK)
Contoh:
N2O : nitrogen (I) oksida
NO : nitrogen (II) oksida
N2O3
: nitrogen (III) oksida
b) Jumlah masing-masing
atom dalam senyawa ditandai dengan awalan
bahasa Yunani (SISTEM AWALAN)
mono =
1, heksa = 6
di =
2, hepta = 7
tri =
3, okta = 8
tetra = 4, nona = 9
penta = 5, deka = 10.
Contoh
N2O :
dinitrogen oksida
N2O3
: dinitrogen trioksida
PCl5 : phospor
pentaoksida 7. Rumus kimia senyawa kovalen dari namanya
8. Rumus senyawa ion dari namanya
bisa dilihat di keterangan no 4 dan 5
9. 10. 11. 12. 13 14 Hukum hukum dasar kimia
HUKUM KEKEKALAN MASSA ( HUKUM LAVOISIER ).
LAVOISIER menyimpulkan bahwa : jika suatu reaksi kimia dilakukan di ruang tertutup sehingga tidak ada zat-zat yang hilang, maka
massa zat-zat sebelum reaksi dan sesudah reaksi tidak berkurang atau tidak bertambah ( tetap ).
dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan reaksi berjalansempurna maka terjadi zat baru, yaitu tembaga ( II ) sulfida. Berapa massa zat baru tersebut ?
jawab :

ternyata massa zat baru tersebut sama dengan massa total zat-zat sebelum reaksi.
Bunyi Hukum Kekekalan Massa : ” JUMLAH MASSA ZAT-ZAT SEBELUM DAN SESUDAH REAKSI ADALAH SAMA “
HUKUM PERBANDINGAN TETAP ( HUKUM PROUST )
Bunyi Hukum Perbandingan Tetap :
” DALAM SUATU SENYAWA, PERBANDINGAN MASSA UNSUR-UNSUR PENYUSUNNYA SELALU TETAP “
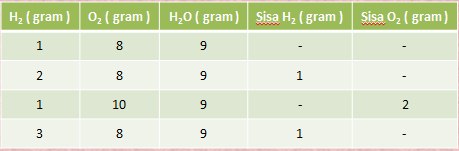
Pada percobaan 1 gram hidrogen dicampur dengan 8 gram oksigen hasilnya ialah 9 gram air. Dan ternyata 8 gram oksigen hanya dapat bereaksi dengan 1 gram hidrogen saja.
Data Percobaan Hidrogen dan Oksigen
contoh soal :Jika kita mereaksikan 4 gram hidrogen dengan 40 gram oksigen, berapa gram air yang terbentuk?
jawab :

HUKUM PERBANDINGAN BERGANDA ( HUKUM DALTON )
” Bila unsur-unsur dapat membentuk dua macam senyawa atau lebih, dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana “
Contoh :
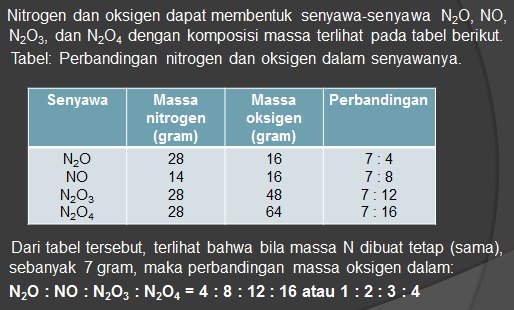
HUKUM PERBANDINGAN VOLUME ( HUKUM GAY LUSSAC )
” Pada temperatur dan tekanan yang sama,
perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi
merupakan perbandingan bilangan bulat dan sederhana “
Pada reaksi zat yang wujudnya gas, perbandingan koefisien reaksi ekuivalen dengan perbandingan volume jika reaksi tersebut
dilakukan pada temperatur dan tekanan yang sama.
HIPOTESIS AVOGADRO
“ gas-gas yang volumenya sama, jika diukur pada temperatur dan tekanan yang sama, mengandung jumlah molekul yang sama pula “
Avogadro menjelaskan percobaan Gay Lussac dengan menganggap partikel – partikel gas tidak sebagai atom-atom, tetapi sebagai molekul-molekul

Perbandingan volume gas-gas yang bereaksi dan gas-gas hasil reaksi jika diukur pada temperatur dan tekanan yang sama
akan sesuai dengan perbandingan jumlah molekulnya, akan sama dengan perbandingan koefisien reaksinya
Contoh Soal :
gas hidrogen direaksikan dengan gas oksigen
membentuk 8 liter ( T,P ) uap air. berapa liter gas hidrogen dan gas
oksigen dibutuhkan pada reaksi tersebut ?
Share this:
18. Klasifikasi campuranJenis-jenis Campuran
1. Campuran Homogen adalah campuran yang seluruh bagiannya mempunyai perbandingan komponen
yang sama sehingga sangat sulit untuk membeda-bedakan komponen zat penyusunnya.
Contoh campuran Homogen adalah larutan.
2. Campuran Heterogen adalah campuran yang perbandingan
komponen disetiap bagiannya tidak sama sehingga masih dapat dibedakan zat-zat
penyusunnya. Contoh campuran Heterogen adalah Suspensi
Secara khusus campuran dapat dibedakan kedalam 3 bentuk,
yaitu:
Bentuk-bentuk campuran
1. Larutan
Larutan adalah campuran homogen yang terdiri dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit di dalam larutan disebut zat terlarut , sedangkan zat yang jumlahnya lebih banyak daripada zat-zat lainnya dalam larutan disebut pelarut. Komposisi zat terlarut dan pelarut dalam larutan dinyatakan sebagai konsentrasi larutan. Contoh larutan:
Larutan adalah campuran homogen yang terdiri dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit di dalam larutan disebut zat terlarut , sedangkan zat yang jumlahnya lebih banyak daripada zat-zat lainnya dalam larutan disebut pelarut. Komposisi zat terlarut dan pelarut dalam larutan dinyatakan sebagai konsentrasi larutan. Contoh larutan:
- Larutan garam adalah campuran homogen dari garam dalam air
- Larutan gula adalah campuran homogen dari gula dalam air
- Larutan oralit adalah campuran homogen dari gula dan garam dalam air
Larutan
terdiri dari berbagai jenis. Untuk mengetahuinya silah baca Jenis-jenis
Larutan
2. Suspensi
Suspensi adalah campuran heterogen dari zat padat dalam zat cair dimana terbentuk sedimentasi sehingga batas antar komponen dapat dibedakan tanpa perlu menggunakan mikroskop. Suspensi tampak keruh dan zat yang tersuspensi lambat laun terpisah karena gravitasi dan membentuk sedimentasi.Contoh suspensi:
Suspensi adalah campuran heterogen dari zat padat dalam zat cair dimana terbentuk sedimentasi sehingga batas antar komponen dapat dibedakan tanpa perlu menggunakan mikroskop. Suspensi tampak keruh dan zat yang tersuspensi lambat laun terpisah karena gravitasi dan membentuk sedimentasi.Contoh suspensi:
- Campuran kapur dan air
- Campuran kopi dan air
3. Koloid
Koloid adalah campuran yang keadaannya terletak antara larutan dan suspensi. Koloid merupakan bentuk campuran (sistem dispersi) dua atau lebih zat yang bersifat homogen namun memiliki ukuran partikel terdispersi yang cukup besar (1 - 100 nm), sehingga terkena efek Tyndall. Namun karena koloid merupakan campuran homogen maka partikel terdispersi tidak terpengaruh oleh gaya gravitasi sehingga tidak terbentuk sedimentasi (endapan). Contoh Koloid:
Koloid adalah campuran yang keadaannya terletak antara larutan dan suspensi. Koloid merupakan bentuk campuran (sistem dispersi) dua atau lebih zat yang bersifat homogen namun memiliki ukuran partikel terdispersi yang cukup besar (1 - 100 nm), sehingga terkena efek Tyndall. Namun karena koloid merupakan campuran homogen maka partikel terdispersi tidak terpengaruh oleh gaya gravitasi sehingga tidak terbentuk sedimentasi (endapan). Contoh Koloid:
- Susu, adalah koloid teremulsi dari lemak susu dalam air
- Lem kanji adalah koloid gel dari pati dan air yang dipanaskan
Koloid
terdiri dari bermacam-macam bentuk seperti yang terdapat dalam artikel Macam-macam Koloid, serta
memiliki sifat-sifat tertentu seperti yang tertulis dalam Sifat-sifat Koloid.
Dengan mengetahui jenis-jenis campuran diharapkan kita dapat
membedakan suatu campuran termasuk dalam jenis campuran yang homogen atau
heterogen yang berbentuk larutan, suspensi atau koloid.
19. Pengertian larutan
larutan adalah campuran homogen yang
terdiri dari dua atau lebih zat. Zat yang jumlahnya lebih sedikit di dalam
larutan disebut (zat) terlarut atau solut, sedangkan zat yang
jumlahnya lebih banyak daripada zat-zat lain dalam larutan disebut pelarut
atau solven
20. Klasifikasi larutan
Larutan terbagi menjadi duu menurut daya hantar listriknya yaitu bisa menghantarkan listrik(elektrolit) dan sukar menghantarkan listrik(non elektrolit).
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik dengan memberikan gejala berupa menyalanya lampu pada alat uji atau timbulnya gelmbung gas dalam larutan .Larutan yang menunjukan gejala – gejala tersebut pada pengujian tergolong ke dalam larutan elektrolit.
- Larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik dengan memberikan gejala berupa tidak ada gelembung dalam larutan atau lampu tidak menyala pada alat uji. Larutan yang menunjukan gejala – gejala tersebut pada pengujian tergolong ke dalam larutan non elektrolit.
21. Pengertian elektrolit
Elektrolit merupakan zat yang dapat menghantarkan listrik
Elektrolit adalah suatu zat yang larut atau terurai ke dalam
bentuk ion-ion dan selanjutnya larutan menjadi konduktor
elektrik,
ion-ion merupakan atom-atom
bermuatan elektrik.
Elektrolit bisa berupa air, asam, basa atau berupa senyawa kimia lainnya. Elektrolit
umumnya berbentuk asam,
basa atau garam. Beberapa gas tertentu dapat
berfungsi sebagai elektrolit pada kondisi tertentu misalnya pada suhu tinggi
atau tekanan rendah. Elektrolit kuat identik dengan asam, basa, dan garam kuat. Elektrolit
merupakan senyawa yang berikatan ion dan kovalen polar. Sebagian besar senyawa
yang berikatan ion merupakan elektrolit sebagai contoh ikatan ion NaCl yang
merupakan salah satu jenis garam yakni garam dapur. NaCl dapat menjadi
elektrolit dalm bentuk larutan dan lelehan. atau bentuk liquid dan aqueous.
sedangkan dalam bentuk solid atau padatan senyawa ion tidak dapat berfungsi
sebagai elektrolit
22. Penyebab hantaran listrik elektrolit
Menurut Arhenius, larutan elektrolit dapat menghantarkan arus listrik karena adanya ion-ion yang bergerak bebas. Ion-ion tersebut menghantarkan listrik dalam larutan.
Larutan elektrolit mampu mengantarkan arus listrik karena dalam larutan tersebut terdapat ion-ion ( positif + dan negatif - ) yang terurai.apabila terurai secara sempurna maka larutan itu elektrolit kuat dan jika terurai tidak sempurna maka larutannya Elektrolit lemah
23. Penarikan kesimpulan data uji larutan
Larutan
|
Nyala Lampu
|
Gelembung Gas
|
||
|
Ada
|
Tidak ada
|
Ada
|
Tidak Ada
|
|
| Larutan Ureautan
Larutan Anomia Laruran HCL Larutan Cuka Air aki Larutan alcohol Air laut Larutan H2S Air Kapur Larutan Glukosa |
-
-
√
-
√
-
√
-
√
-
|
√
√
-
√
-
√
-
√
-
√
|
-
√
√
√
√
-
√
√
√
-
|
√
-
-
-
-
√
-
-
-
√
|
24. Peristiwa Ionisasi
HCl(aq) --> H+(aq) + Cl-(aq)
NaCl(aq) --> Na+(aq) + Cl-(aq)
25. Penarikan kesimpulan data uji air dari berbagai sumber
26. Zat elektrolit berupa senyawa ion
27. Zat elektrolit berupa senyawa kovalen
28. Jenis ion hasil reaksi ionisasi garam
29. Reaksi ionisasi asam kuat
30. Reaksi ionisasi basa lemah




Tidak ada komentar:
Posting Komentar