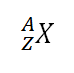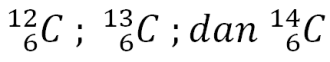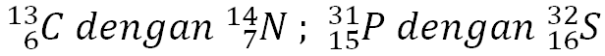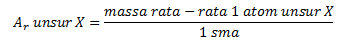Susunan Atom
Atom adalah bagian terkecil dari suatu
unsur yang masih mempunyai sifat-sifat unsur itu. Atom terdiri atas
proton dan neutron. Dalam kaitan dengan susunan atom, perlu memahami
beberapa istilah, yaitu nomor atom, nomor massa, isotop, isobar, dan
isoton.
- Nomor Atom. Jumlah proton dalam suatu atom disebut nomor atom atau
nomor proton. Jumlah proton khas bagi setiap unsur. Nomor atom
unsur-unsur dapat dilihat pada tabel sistem periodik. Oleh karena suatu
atom bersifat netral, maka jumlah elektron sama dengan jumlah proton.
Jadi, nomor atom juga menyatakan jumlah elektron dalam suatu atom
Contoh:Nomor atom = jumlah proton = jumlah elektron
Nomor atom karbon adalah 6, berarti setiap atomm karbon mempunyai 6 proton dan 6 elektron. - Nomor Massa
Proton dan neutron mempunyai massa yang sama, yaitu masing-masing sekitar 1 sma (massa proton = 1,0073 sma; massa neutron = 1,0087 sma), sedangkan massa sebuah elektron sangat kecil, yaitu 5,486 x 10-4 sma. Massa sebuah atom hanya ditentukan oleh massa proton da neutronnya, sedangkan massa elektron dapat diabaikan. Jumlah proton dengan neutron dalam suatu atom disebut nomor massa.nomor massa = jumlah proton + jumlah neutron
- Notasi Susunan Atom. Jumlah proton, elektron, dan neutron dalam suatu atom dinyatakan dengan lambang (notasi) sebagai berikut.
dimana,
X = lambang atom (=lambang unsur)
Z = nomor atom = jumlah proton (p) = jumlah elektron (e)
A = nomor massa = jumlah proton + jumlah neutron = p+n
Oleh karena A = p + n, sedangkan p= Z, maka A= Z + n atau n = A – Z. Jadi, jumlah neutron dalam suatu atom sama dengan selisih nomor massa dengan nomor atomnya.
jumlah neutron (n) = A — ZContoh: menyatakan atom alumunium dengan nomor atom 13 dan nomor massa 27. Atom ini mempunyai jumlah proton = 13, jumlah elektron = 13, dan jumlah neutron = 27 – 13 = 14 - Isotop. Sebelumnya, telah disebutkan bahwa atom-atom dari unsur yang sama dapat mempunyai massa yang berbeda. Fenomena ini disebut isotop. Isotop terjadi karena perbedaan jumlah neutron dalam inti atom
- Isobar dan Isoton
a) Isobar. Atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi mempunyai nomor massa sama disebut isobar. Contoh:b) Isoton
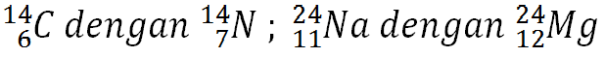
- Susunan Ion
Suatu atom dapat kehilangan elektron atau mendapat elektron tambahan. Atom yang kehilangan elektron akan menjadi ion positif, sedangkan atom yang mendapat tambahan elektron akan menjadi ion negatif.
Massa Atom dan Massa Atom Relatif
Massa atom relatif adalah perbandingan
massa antara atom yang satu terhadap atom yang lainnya. Massa pembanding
yang telah disepakati adalah 1⁄12 dari massa 1 atom C-12. Oleh karena
umumnya unsur terdiri dari beberapa isotop, maka pada penetapan massa
atom relatif digunakan massa rata-rata dari isotop-isotopnya. Dengan
demikian, massa atom relatif adalah perbandingan antara massa rata-rata
dari 1 atom suatu unsur terhadap 1⁄12 massa 1 atom C-12.
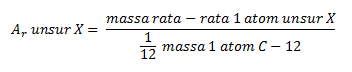
Satu perduabelas massa 1 atom C-12 ditetapkan sama dengan 1 sma, maka definisi di atas dapat ditulis sebagai berikut.
Dengan menata ulang persamaan di atas, diperoleh:
Dengan perkataan lain, massa atom relatif suatu unsur merupakan massa rata-rata dari 1 atom unsur itu dalam satuan sma.
NOMOR MASSA ATOM
NOMOR MASSA ATOM
Suatu
atom memiliki sifat dan massa yang khas satu sama lain. Dengan penemuan
partikel penyusun atom dikenal istilah nomor atom (Z) dan nomor massa
(A).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||